每日經濟新聞 2023-03-10 18:39:40
◎和鉑醫藥的HBM1020注射液首度申報臨床,據悉,HBM1020注射液是一款靶向B7H7的全球首創全人源單克隆抗體。目前在免疫腫瘤學領域,絕大多數經過臨床驗證的靶點都與B7家族有關。作為新近發現的B7家族成員之一,B7H7在多種難治腫瘤中表達,幫助腫瘤細胞逃避免疫系統的監測。
◎康寧杰瑞兩款1類創新藥再度申報臨床,分別為重組人源化PDL1/CTLA-4雙特異性單域抗體Fc融合蛋白注射液和重組人源化抗HER2雙特異性抗體注射液。目前,這兩款產品已有多項試驗處于Ⅲ期臨床階段。
每經記者|陳浩 每經編輯|魏官紅

《掘金創新藥》由每日經濟新聞聯合藥渡數據共同推出,旨在解讀新藥研發進展與趨勢,剖析產品競爭力與市場前景,洞察醫藥資本脈絡,見證醫藥產業高質量發展。

根據藥渡數據,2023年2月20日至2023年3月5日,國家藥品監督管理局藥品審評中心(CDE)共收到15家上市公司(含上市公司控股公司)提交的20個化學新藥、治療用生物制品新藥申請(同一公司同一藥物不同規格的申報,不分開計算)。

2023年2月20日至2023年3月5日期間,上市公司方面,邁威生物、辰欣藥業、諾誠健華、東陽光藥、香雪制藥、陽光諾和、復宏漢霖、和鉑醫藥、信立泰、翰森制藥、君實生物、天境生物各提交1個臨床申請,康寧杰瑞共提交2個臨床申請,恒瑞醫藥共提交5個臨床申請,基石藥業提交1個生產申請。

1.和鉑醫藥B7H7單抗中美雙報臨床
2月24日,CDE官網顯示,和鉑醫藥的HBM1020注射液首度申報臨床。據悉,HBM1020注射液是一款由和鉑醫藥Harbour Mice®H2L2轉基因小鼠平臺開發的靶向B7H7的全球首創全人源單克隆抗體,該抗體通過阻斷免疫檢查點靶點和配體的結合,增強抗腫瘤免疫。
和鉑醫藥表示,HBM1020注射液因其創新的生物學機制,有望為難以從PD-(L)1抑制劑中獲益的患者提供一種全新的抗腫瘤治療方法。公司曾在1月12日發布公告稱,HBM1020注射液已獲得FDA的新藥研究申請許可,將在美國啟動相關臨床試驗。值得一提的是,HBM1020注射液是全球首個正式獲批進入臨床階段的抗B7H7單克隆抗體。
行業洞察:
資料顯示,B7H7是一種新型免疫調節分子,屬于B7家族成員。B7家族在調節T細胞反應方面至關重要,在癌癥免疫治療方面受到業界的廣泛關注。目前在免疫腫瘤學領域,絕大多數經過臨床驗證的靶點都與B7家族有關,包括PD-(L)1及CTLA-4。作為新近發現的B7家族成員之一,B7H7在多種難治腫瘤中表達,幫助腫瘤細胞逃避免疫系統的監測。
研究發現,B7H7在多種腫瘤組織中呈高表達,如乳腺癌(70.0%)、肺癌(66.7%)、甲狀腺癌(66.7%),黑色素瘤(55.6%)、卵巢癌(50.0%)、胰腺癌(50.0%)、肝癌(40.0%)、膀胱癌(40.0%)、結腸癌(37.5%)、前列腺癌(33.3%)、腎癌(33.3%)和食道癌(20.0%),這提示B7H7有可能成為腫瘤免疫檢查及治療的新靶點。
公司點評:
和鉑醫藥主攻腫瘤和免疫性疾病,目前暫無商業化產品獲批。2019年至2021年期間累計虧損近5億美元。2022年上半年,公司實現營收2763萬美元,主要來源于公司與阿斯利康簽訂的關于HBM7022的授權協議,公司獲得2500萬美元的預付款和最高3.25億美元的里程碑付款。
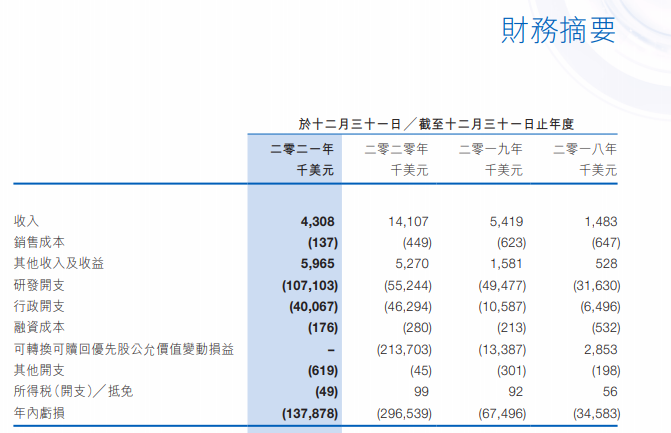
圖片來源:公司財報截圖
License-out是創新藥企BD業務的重要組成部分,也是企業高效推動研發管線的重要途徑。除HBM7022外,今年2月,和鉑醫藥宣布,公司與Cullinan Oncology,Inc.簽訂授權及合作協議,授予該公司在美國(包括哥倫比亞特區和波多黎各)開發及商業化HBM7008的獨家許可權。HBM7008是一款針對B7H4x4-1BB的雙特異性抗體,根據協議,和鉑醫藥將獲得2500萬美元預付款和最高6億美元里程碑付款。
和鉑醫藥的首款商業化產品距離面世已不遠。3月6日,公司披露巴托利單抗(HBM9161)治療全身型重癥肌無力(gMG)的III期臨床試驗取得積極研究結果,該關鍵臨床研究旨在確認巴托利單抗在治療相關全身型重癥肌無力患者時的療效及安全性。
巴托利單抗是和鉑醫藥從HanAll Biopharma引進的全球創新藥,公司擁有在大中華地區進行開發、制造和商業化的權利。和鉑醫藥表示,隨著III期臨床試驗取得積極研究結果,標志著公司首款完成III期臨床試驗的產品正式進入商業化準備階段。
《掘金創新藥》研究員注意到,2022年以來,和鉑醫藥陸續開展了包括License-out、技術授權等多個BD項目,多元化的BD項目為公司提供了成長動力,也促進了公司研發管線的進展。但另一方面,在新藥研發“九死一生”的背景下,公司的多個BD項目或仍存變數。
2.兩款雙抗再度申報臨床,康寧杰瑞商業化提速
2月28日,CDE官網顯示,康寧杰瑞兩款1類創新藥再度申報臨床,分別為重組人源化PDL1/CTLA-4雙特異性單域抗體Fc融合蛋白注射液(KN046)和重組人源化抗HER2雙特異性抗體注射液(KN026)。目前,這兩款產品已有多項試驗處于Ⅲ期臨床階段。
據悉,KN046在澳大利亞、美國和中國已開展覆蓋非小細胞肺癌、胰腺癌、胸腺癌、肝癌、食管鱗癌、三陰乳腺癌等10余種腫瘤的20多項不同階段臨床試驗。并且,2020年9月,FDA授予KN046用于治療胸腺上皮腫瘤的孤兒藥資格。
KN026是公司自主開發的一款抗HER2雙特異性抗體,可以同時結合HER2的兩個非重疊表位,阻斷HER2信號。KN026于2018年分別在中國和美國獲批進入臨床階段,目前正在兩國開展多項不同階段臨床試驗,適應癥包括乳腺癌、胃癌/胃食管結合部癌等。
行業洞察:
雙特異性抗體具有兩個不同抗原結合位點的抗體,因此能夠發揮比單抗更復雜的生物學機制,較單抗有顯著優勢。雙抗是當前醫藥研發最炙手可熱的領域之一,被譽為“下一代抗體藥物”。東方財富證券研報顯示,截至2022年9月,全球共有八款雙特異性抗體獲批上市,同時超50家國內企業布局雙抗賽道。
2022年6月29日,康方生物的PD-1/CTLA-4雙抗卡度尼利單抗(開坦尼)獲批上市,用于治療既往接受含鉑化療失敗的復發或轉移性宮頸癌患者,這也是首款獲批上市的國產雙抗。目前,我國已有3款雙抗藥物獲批上市,艾美賽珠單抗(舒友立樂)和貝林妥歐單抗(倍利妥)分別在2018年和2020年在國內獲得上市批準。
東方財富證券研報稱,隨著不同企業雙抗研發平臺逐漸成熟,多款藥物進入臨床階段,國產雙抗有望持續商業化;受益于藥品臨床價值、產品獲批數量及適應癥擴大,據沙利文統計,我國雙抗市場規模在2030年將達647億元,約為ADC藥物市場空間的2倍。
公司點評:
2021年稱得上是康寧杰瑞的商業化元年。2021年11月,國家藥監局附條件批準公司的恩沃利單抗(KN035)上市,用于治療不可切除或轉移性MSI-H/dMMR晚期實體瘤,成為公司首款商業化產品,其也是全球首款皮下注射的PD-L1產品。此外,恩沃利單抗目前還在中國、美國和日本開展多個腫瘤適應癥的臨床研究。
但國內PD-(L)1賽道競爭愈發激烈,目前國內共有13款PD-(L)/1獲批。白熱化競爭下,PD-(L)/1藥物價格戰加劇,市場規模也低于預期。恩沃利單抗曾出現在2022年國家醫保藥品目錄談判初審名單中,但最終沒能進入醫保目錄。
盡管已有首款商業化產品獲批上市,但康寧杰瑞仍未到扭虧為盈的節點。2022年上半年,公司實現總收入7530萬元,期內虧損1.47億元。
相較于恩沃利單抗,康寧杰瑞對KN046和KN026兩款雙抗產品則抱有更多的期待。康寧杰瑞表示,預計將于2023年、2024年分別提交KN046、KN026的新藥上市申請。此外,KN026聯合KN046無化療一線治療HER2陽性局部進展不可切除或轉移性胃/胃食管結合部癌的Ⅲ期關鍵性臨床研究正在進行中。在2020年,KN026與KN046聯合療法獲FDA授予孤兒藥資格,用于治療HER2-陽性或HER2-低表達胃癌及胃食管連接部癌。在上述兩款雙抗產品臨床動作頻頻的情況下,康寧杰瑞的商業化進程有望提速。

封面圖片來源:視覺中國-VCG41N923766082
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
