每日經濟新聞 2021-07-19 21:34:41
◎本階段PD-1仍是藥企研發熱點:百濟神州申報第8項適應癥,“樂普系”新兵樂普生物PD-1申報上市,適應癥為黑色素瘤。《掘金創新藥》研究員認為,對于百濟神州而言,若上述適應癥獲批,百濟神州繼續追趕恒瑞醫藥的進程在適應癥數量上差距縮小。對于樂普生物來說,雖然PD-1獲批能成為公司第一個上市的產品,但黑色素瘤屬于小癌癥,又直面與默沙東、君實生物的競爭,能有多大市場份額還是個未知數。
每經記者|金喆 每經實習記者|林姿辰 每經編輯|魏官紅

《掘金創新藥》由每日經濟新聞聯合丁香園Insight數據庫共同推出,旨在解讀新藥研發進展與趨勢,剖析產品競爭力與市場前景,洞察醫藥資本脈絡,見證醫藥產業高質量發展。
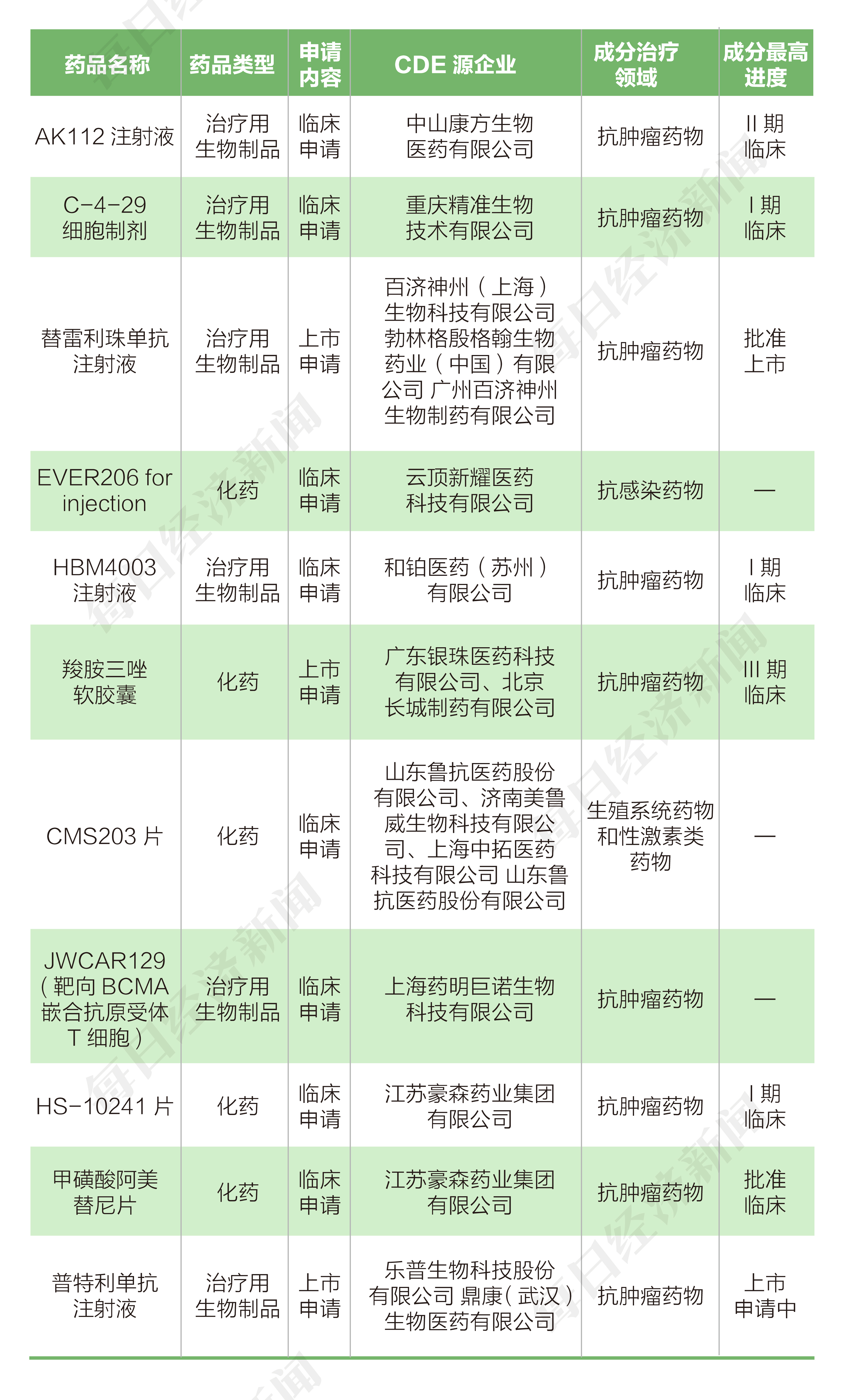
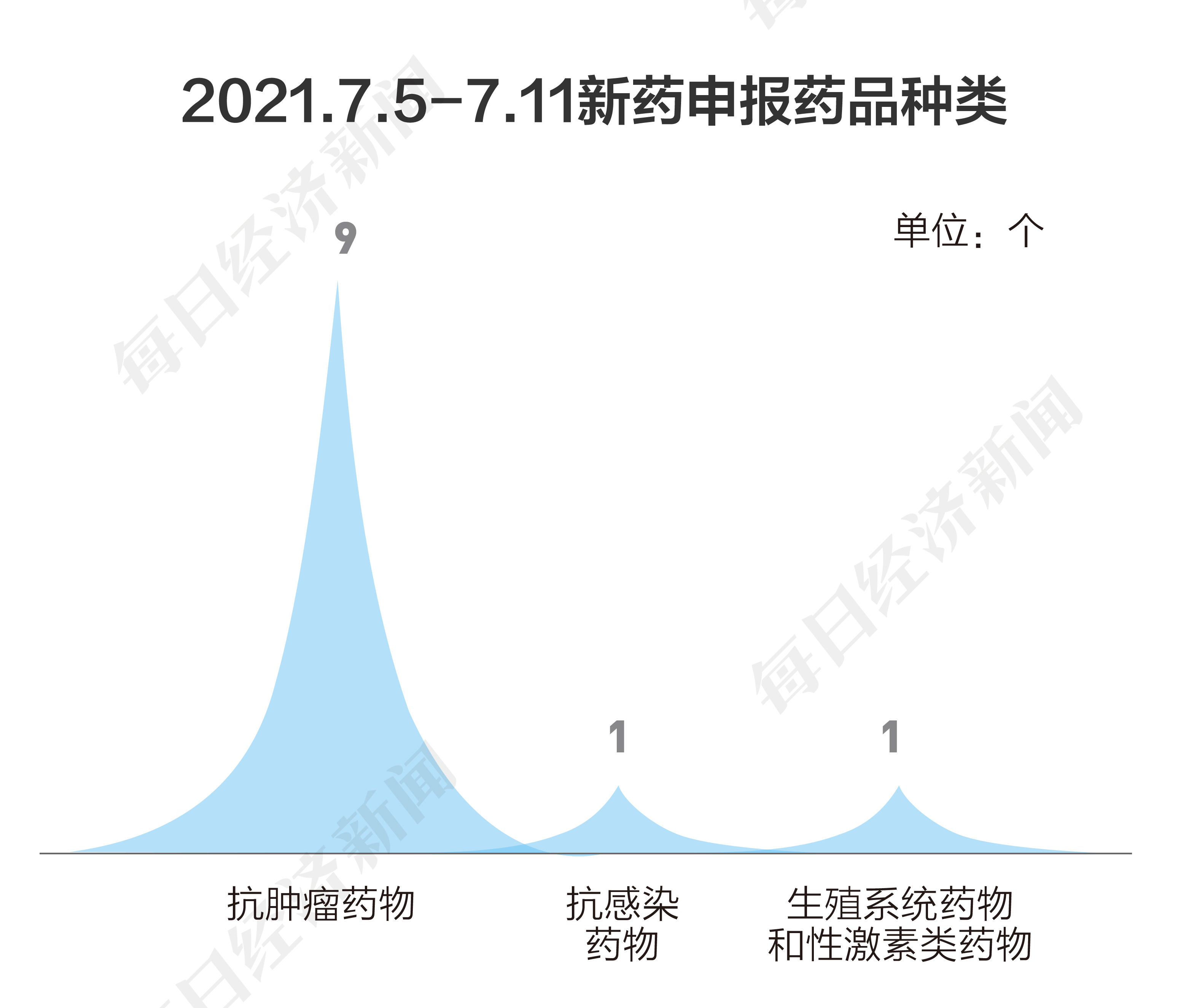
根據丁香園Insight數據庫統計,7月5日到7月11日,國家藥品監督管理局藥品審評中心(CDE)共收到10家上市公司提交的11個化學新藥、生物制品新藥申請。

本階段PD-1仍是藥企研發熱點:百濟神州申報第8項適應癥,“樂普系”新兵樂普生物PD-1申報上市,適應癥為黑色素瘤。
《掘金創新藥》研究員認為,雖然同是在PD-1領域競爭,不同的研發進度對于兩家企業的意義也大不相同。對于百濟神州而言,若上述適應癥獲批,百濟神州繼續追趕恒瑞醫藥的進程在適應癥數量上差距縮小。對于樂普生物來說,雖然PD-1獲批能成為公司第一個上市的產品,但黑色素瘤屬于小癌癥,又直面與默沙東、君實生物的競爭,能有多大市場份額還是個未知數。
本周,翰森制藥(03692.HK)共申報2個臨床申請;康方生物-B(09926.HK)、智飛生物(300122.SZ)、云頂新耀-B(01952.HK)、和鉑醫藥-B(02142.HK)、魯抗醫藥(600789.SH)、藥明巨諾(02126.SZ)各遞交1個新藥臨床申請;百濟神州(06160.HK)、中國醫藥(600056.SH)、樂普醫療(300003.SZ)各遞交1個上市申請。
按申請類別劃分,本階段申報類別情況如下:
1、百濟神州PD-1百澤安第8項適應癥申報上市,為全球首個食管鱗狀細胞癌3期研究
7月8日,百濟神州發布公告稱,國家藥品監督管理局藥品審評中心已受理其抗PD-1抗體藥物百澤安(替雷利珠單抗注射液)用于治療既往接受過一線標準化療后進展或不可耐受的局部晚期或轉移性食管鱗狀細胞癌(ESCC)患者的新適應癥上市申請。
這是百澤安申請的第8個適應癥,目前,百澤安已獲批5個適應癥,分別覆蓋霍奇金淋巴瘤、尿路上皮癌、鱗狀非小細胞肺癌、非鱗狀非小細胞肺癌和肝細胞癌。另外2項新適應癥上市申請也于今年被受理,分別覆蓋非小細胞肺癌和實體瘤。
根據披露,百澤安此次申請的新適應癥基于一項隨機、開放性、多中心的全球3期臨床試驗RATIONALE 302的研究結果,而這也是首個全球食管鱗狀細胞癌的3期研究。
在今年6月的美國臨床腫瘤學會年會(ASCO)上,百濟神州曾公布RATIONALE 302亮眼的臨床試驗研究數據,即主要終點意向性治療(ITT)人群的中位總生存期(OS)達8.6個月,降低死亡風險超過30%,且客觀緩解率(ORR)達20.3%。
在目前上市的4個國產PD-1產品中,百濟神州的百澤安在2019年底才獲得CDE批準,上市次序最末,較君實生物的拓益(特瑞普利單抗)晚了足足一年,但在適應癥上奮起直追,適應癥在數量上僅次于恒瑞醫藥的艾瑞卡(卡瑞利珠單抗)。
國內競爭激烈,PD-1都把眼光瞄準海外市場。今年1月,百濟神州憑借替雷利珠單抗與諾華達成合作,以共同開發和商業化抗PD-1抗體替雷利珠單抗,并以22億美元的總交易金額創下國內藥物授權合作項目的金額最高紀錄。
從資本市場上看,7月5日至9日,百濟神州股價漲幅為-5.85%。《掘金創新藥》研究員分析認為,這或與CDE在7月2日發布的一則“關于公開征求《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則》意見的通知”(以下簡稱《指導原則》)有關,該《指導意見》中對藥物進行臨床對照試驗的兩項要求,被認為是導致市場大跌的導火索。
研究員認為,《指導原則》的目的是遏制低效同質化的“偽創新”,的確對進行me-too和me-better類藥物研發的企業提出更高要求,短期內可能有一些過度重復研究的項目被叫停,但長遠來看也會倒逼企業加速創新,仍然利好真正做創新、具備研究潛力的龍頭企業。因此,對于百濟神州這類創新藥企而言,政策引導更利于行業競爭。
2、赴港IPO下樂普生物PD-1申請上市,適應癥黑色素瘤已有兩企業獲批
7月5日,CDE官網顯示,樂普生物核心產品普特利單抗注射液(以下簡稱普特利單抗)新藥上市申請獲得受理。這是國內第11款申報上市的PD-1單抗,也是樂普生物向CDE申請上市的首款藥物。
作為國內醫療器械巨頭樂普醫療的子公司,樂普生物從2018年成立起就備受市場關注,自其宣布分拆赴港IPO計劃以來,其產品研發管線中的PD-1藥物更被視為上市募資的規劃重點。
根據招股說明書,樂普生物計劃于2021年分別就普特利單抗的兩項適應癥,即黑色素瘤和衛星不穩定/錯配修復功能缺陷實體瘤,向NMPA提交新藥上市申請,而據媒體報道,樂普生物此次申請的適應癥正是黑色素瘤。
根據弗若斯特沙利文分析,2019年,國內新發病人數為為7563人,每年適用于黑色素瘤的PD-1市場規模大概是4億元,只占腫瘤市場的1%左右。
另外,黑色素瘤這一適應癥早有巨頭搶先布局達三年之久。2018年7月和12月,默沙東的K藥(帕博利珠單抗)和君實生物的拓益(特瑞普利單抗)先后上市,可用于治療黑色素瘤。當時,樂普生物的PD-1之旅才以外購的形式剛剛起步。
《掘金創新藥》研究員認為,即便樂普生物首款PD-1順利上市,適應癥是小癌種黑色素瘤,但面對默沙東、君實生物這些強勁對手,能搶多大市場份額還要打個問號。
起步的差距決定了樂普生物需要在適應癥和市場推廣上跑得更快。單從研發上看,與“四大天王”選擇自研不同,普特利單抗并非樂普生物自己研發,而是從泰州翰中生物醫藥有限公司收購得來;而在推廣方面,招股書顯示,樂普生物計劃于2022年一季度前建立銷售團隊,由董事長蒲忠杰直接領導,預計向各個省份派遣5到10名成員,即銷售團隊規模在200人左右。但PD-1“四大天王”中,除了君實生物跟阿斯利康合作銷售,其他三家的銷售團隊都在千人級別。由此看來,樂普生物的百人團隊相比之下還是有很大差距。
根據招股書,樂普生物的產品管線中有8種臨床階段候選藥物、3種主要候選藥物及3種臨床階段的候選藥物的聯合療法;并已經啟動28項候選藥物的臨床試驗,其中3項臨床試驗已進入注冊性試驗階段,2項臨床試驗正在美國進行。
封面圖片來源:攝圖網
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
